Ein Chromophor ist der Teil eines Moleküls, der für seine Farbe verantwortlich ist. Die Farbe, die von unseren Augen gesehen wird, ist diejenige, die nicht in einem bestimmten Wellenlängenspektrum des sichtbaren Lichts absorbiert wird. Das Chromophor ist eine Region im Molekül, in der die Energiedifferenz zwischen zwei getrennten Molekülorbitalen in den Bereich des sichtbaren Spektrums fällt. Sichtbares Licht, das auf das Chromophor trifft, kann somit absorbiert werden, indem ein Elektron von seinem Grundzustand in einen angeregten Zustand angeregt wird.
In biologischen Molekülen, die dazu dienen, Lichtenergie einzufangen oder zu detektieren, ist das Chromophor die Einheit, die eine Konformationsänderung des Moleküls bewirkt, wenn es von Licht getroffen wird.
Konjugierte Pi-Bindungssystem-Chromophore
In den konjugierten Chromophoren springen die Elektronen zwischen Energieniveaus, die pi-Orbitale erweitert werden, die durch eine Reihe abwechselnder Einfach- und Doppelbindungen erzeugt werden, oft in aromatischen Systemen. Gängige Beispiele sind Retinal (im Auge zum Nachweis von Licht), verschiedene Lebensmittelfarbstoffe, Gewebefarbstoffe (Azoverbindungen), pH-Indikatoren, Lycopin, β-Carotin und Anthocyane. Verschiedene Faktoren in der Struktur eines Chromophors bestimmen, bei welchem Wellenlängenbereich in einem Spektrum der Chromophor absorbiert. Das Verlängern oder Verlängern eines konjugierten Systems mit mehr ungesättigten (Mehrfach-) Bindungen in einem Molekül wird dazu neigen, die Absorption zu längeren Wellenlängen zu verschieben. Woodward-Fieser-Regeln können verwendet werden, um die maximale Absorptionswellenlänge im ultravioletten und sichtbaren Bereich in organischen Verbindungen mit konjugierten pi-Bindungssystemen zu approximieren.
Einige davon sind Metallkomplexchromophore, die ein Metall in einem Koordinationskomplex mit Liganden enthalten. Beispiele sind Chlorophyll, das von Pflanzen für die Photosynthese genutzt wird, und Hämoglobin, der Sauerstofftransporter im Blut von Wirbeltieren. In diesen zwei Beispielen ist ein Metall in der Mitte eines Tetrapyrrol-Makrocyclusringes komplexiert: das Metall ist Eisen in der Hämgruppe (Eisen in einem Porphyrinring) von Hämoglobin oder Magnesium komplexiert in einem Chlorinring im Fall von Chlorophyll . Das hochkonjugierte Pi-Bindungssystem des Makrocyclus-Rings absorbiert sichtbares Licht. Die Art des Zentralmetalls kann auch das Absorptionsspektrum des Metall-Makrocyclus-Komplexes oder Eigenschaften wie die Lebensdauer des angeregten Zustands beeinflussen. Die Tetrapyrroleinheit in organischen Verbindungen, die nicht makrocyclisch ist, aber immer noch ein konjugiertes pi-Bindungssystem aufweist, wirkt immer noch als ein Chromophor. Beispiele für solche Verbindungen umfassen Bilirubin und Urobilin, die eine gelbe Farbe zeigen.
Auxochrom
Ein Auxochrom ist eine funktionelle Gruppe von Atomen, die an das Chromophor gebunden sind und die Fähigkeit des Chromophors, Licht zu absorbieren, verändern, wodurch die Wellenlänge oder Intensität der Absorption verändert wird.
Halochromie in Chromophoren
Halochromie tritt auf, wenn eine Substanz die Farbe ändert, wenn sich der pH-Wert ändert. Dies ist eine Eigenschaft von pH-Indikatoren, deren molekulare Struktur sich bei bestimmten Änderungen des umgebenden pH-Wertes ändert. Diese Änderung der Struktur beeinflusst ein Chromophor in dem pH-Indikatormolekül. Zum Beispiel ist Phenolphthalein ein pH-Indikator, dessen Struktur sich ändert, wenn sich der pH-Wert ändert, wie in der folgenden Tabelle gezeigt:
| Structure | 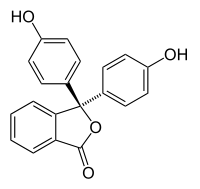 |
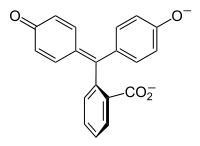 |
|---|---|---|
| pH | 0-8.2 | 8.2-12 |
| Conditions | acidic or near-neutral | basic |
| Color name | colorless | pink to fuchsia |
| Color |
In einem pH-Bereich von etwa 0-8 hat das Molekül drei aromatische Ringe, die alle an ein tetraedrisches sp3-hybridisiertes Kohlenstoffatom in der Mitte gebunden sind, was die π-Bindung in den aromatischen Ringen nicht konjugiert. Aufgrund ihres begrenzten Ausmaßes absorbieren die aromatischen Ringe nur Licht im ultravioletten Bereich, und so erscheint die Verbindung im pH-Bereich von 0-8 farblos. Wenn der pH-Wert jedoch über 8,2 ansteigt, wird dieser zentrale Kohlenstoff Teil einer Doppelbindung, die sp2-hybridisiert wird und ein p-Orbital übrig lässt, das mit der π-Bindung in den Ringen überlappt. Dadurch werden die drei Ringe miteinander konjugiert, um ein verlängertes Chromophor zu bilden, das längerwelliges sichtbares Licht absorbiert, um eine fuchsiafarbene Farbe zu zeigen. Bei pH-Bereichen außerhalb von 0-12 führen andere Änderungen der Molekülstruktur zu anderen Farbänderungen; siehe Phenolphthalein für Details.