Un orgue imprimable est un dispositif artificiel conçu pour le remplacement d’un orgue, fabriqué à l’aide de techniques d’impression 3D. Le principal objectif des organes imprimables est la transplantation. Des recherches sont en cours sur les structures artificielles du cœur, des reins et du foie, ainsi que sur d’autres organes importants. Pour des organes plus complexes, tels que le cœur, des constructions plus petites telles que des valves cardiaques ont également fait l’objet de recherches. Certains organes imprimés se rapprochent des exigences de fonctionnalité pour la mise en œuvre clinique et comprennent principalement des structures creuses telles que la vessie, ainsi que des structures vasculaires telles que des tubes pour l’urine.
L’impression 3D permet la construction couche par couche d’une structure d’organe particulière afin de former un échafaudage cellulaire. Cela peut être suivi du processus d’ensemencement cellulaire, dans lequel les cellules d’intérêt sont pipetées directement sur la structure de l’échafaudage. De plus, le processus d’intégration de cellules dans le matériau imprimable lui-même, au lieu d’effectuer un ensemencement par la suite, a été exploré.
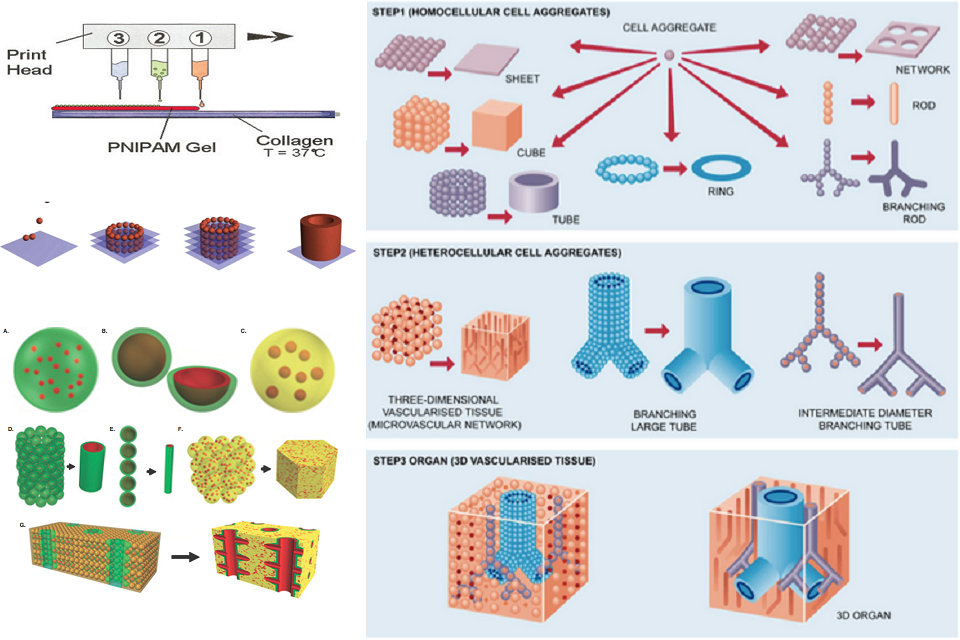
Des imprimantes à jet d’encre modifiées ont été utilisées pour produire un tissu biologique tridimensionnel. Les cartouches d’imprimante sont remplies d’une suspension de cellules vivantes et d’un gel intelligent, ce dernier étant utilisé pour fournir une structure. Des motifs alternés du gel intelligent et des cellules vivantes sont imprimés à l’aide d’une buse d’impression standard, les cellules fusionnant finalement pour former un tissu. Une fois terminé, le gel est refroidi et lavé, ne laissant que des cellules vivantes.
Histoire
L’impression 3D pour la production d’une construction cellulaire a été introduite pour la première fois en 2003, lorsque Thomas Boland de Clemson Université breveté l’utilisation de l’impression à jet d’encre pour les cellules. Ce processus utilisait un système de détachage modifié pour le dépôt de cellules dans des matrices 3D organisées placées sur un substrat.
Depuis les premières découvertes de Boland, l’impression 3D de structures biologiques, également appelée bioprinting, a été développée pour englober la production de structures de tissus et d’organes, par opposition aux matrices cellulaires. En outre, davantage de techniques pour l’impression, telles que la bio-impression par extrusion, ont été étudiées et ensuite introduites en tant que moyen de production.
L’impression d’organes a été abordée comme une solution potentielle à la pénurie mondiale d’organes de donneurs. Les organes qui ont été imprimés et mis en œuvre avec succès dans un contexte clinique sont soit plats, tels que peau, vasculaires, tels que vaisseaux sanguins, ou creux, tels que la vessie. Lorsque des organes artificiels sont préparés pour la transplantation, ils sont souvent produits avec les propres cellules du receveur.
Des organes plus complexes, à savoir ceux constitués de structures cellulaires solides, sont en cours de recherche; ces organes comprennent le cœur, le pancréas et les reins. Les estimations quant au moment où de tels organes peuvent être introduits en tant que traitement médical viable varient. En 2013, la société Organovo a produit un foie humain utilisant la bioimpression 3D, bien qu’il ne soit pas adapté à la transplantation et qu’il a principalement été utilisé comme support pour le dépistage de drogues.
Approches
Les chercheurs ont développé différentes approches pour produire des organes synthétiques vivants. La bio-impression 3D repose sur trois approches principales: la biomimétrie, l’auto-assemblage autonome et la construction de mini blocs de tissus.
Biomimétrie
La première approche de la bio-impression s’appelle le biomimétisme. L’objectif principal de cette approche est de créer des structures identiques aux structures naturelles. La biomimétrie nécessite la duplication de la forme, du cadre et du micro-environnement des organes et des tissus. L’application de la biomimétrie en bio-impression implique la copie identique des parties cellulaires et extracellulaires des organes. Pour que cette approche réussisse, une réplication tissulaire à l’échelle du micron est nécessaire. Ce degré de précision implique de comprendre le microenvironnement, la nature des forces biologiques, l’organisation précise des cellules, les facteurs de solubilité, ainsi que la composition et la structure de la matrice extracellulaire.
Auto-assemblage
La deuxième approche utilisée en bio-impression est l’auto-assemblage autonome. Cette approche repose sur le processus physique naturel de développement des organes embryonnaires. Lorsque les cellules sont dans leur phase de développement précoce, elles créent leur propre bloc de construction de matrice extracellulaire, produisent leur propre signalisation cellulaire et prennent la disposition et la microarchitecture nécessaires pour fournir les fonctions biologiques attendues. L’auto-assemblage autonome nécessite la connaissance des processus de développement des tissus et des organes de l’embryon. L’auto-assemblage autonome repose sur les capacités des cellules en tant que pierre angulaire de l’histogenèse. Cette technique nécessite donc une compréhension très approfondie des mécanismes de développement des tissus embryonnaires ainsi que des micro-environnements dans lesquels les tissus se développent.
Mini-tissu
La troisième approche de la bio-impression est une combinaison d’approches biomimétiques et d’auto-assemblage. Cette technique est appelée « mini-tissus ». Les organes et les tissus sont fabriqués à partir de très petits composants fonctionnels. L’approche en mini-tissu consiste à prendre ces petites pièces et à les disposer dans une structure plus grande. Cette approche utilise deux stratégies différentes. La première stratégie consiste à utiliser des sphères de cellules auto-assemblées dans des tissus à grande échelle, en utilisant des modèles naturels comme guide. La deuxième stratégie consiste à développer des reproductions précises et une haute qualité de tissu et à leur permettre de se monter automatiquement dans de grands tissus fonctionnels à l’échelle. Le mélange de ces stratégies est nécessaire pour imprimer une structure biologique complexe en trois dimensions.
L’impression d’organes offre un grand potentiel pour les technologies NBIC (nano, bio, info et cognitives) permettant de faire progresser les procédures médicales et chirurgicales, de gagner du temps, de réduire les coûts et de créer de nouvelles opportunités pour les patients et les patients. professionnels de la santé.
Techniques d’impression 3D
L’impression 3D pour la fabrication d’organes artificiels a été un sujet d’étude majeur en génie biologique. À mesure que les techniques de fabrication rapides liées à l’impression 3D deviennent de plus en plus efficaces, leur applicabilité à la synthèse d’organes artificielle est devenue plus évidente. L’un des principaux avantages de l’impression 3D réside dans sa capacité à produire en masse des structures d’échafaudage, ainsi que dans le degré élevé de précision anatomique des produits d’échafaudage. Cela permet la création de constructions qui ressemblent plus efficacement à la microstructure d’un organe naturel ou d’une structure tissulaire.
L’impression d’organes à l’aide de l’impression 3D peut être réalisée à l’aide d’une variété de techniques, chacune d’elles conférant des avantages spécifiques pouvant être adaptés à des types particuliers de production d’organes. L’impression biologique à partir de gouttes et l’extrusion biologique sont deux des types les plus connus d’impression d’organes. Il en existe de nombreux autres, mais ils ne sont pas aussi couramment utilisés ou sont encore en développement.
Bioprinting à base de gouttes (jet d’encre)
La bioimpression à base de gouttes crée des constructions cellulaires à l’aide de gouttelettes individuelles d’un matériau désigné, qui ont souvent été combinées à une lignée cellulaire. Lors du contact avec la surface du substrat, chaque gouttelette commence à polymériser, formant une structure plus grande au fur et à mesure que les gouttelettes individuelles commencent à fusionner. La polymérisation est provoquée par la présence d’ions calcium sur le substrat, qui diffusent dans le bioink liquéfié et permettent la formation d’un gel solide. La bioimpression à base de gouttes est couramment utilisée en raison de sa vitesse efficace, bien que cet aspect le rende moins bien adapté aux structures d’organes plus complexes.
Extrusion bioprinting
La bioimpression par extrusion implique le dépôt constant d’un matériau d’impression particulier et d’une lignée cellulaire provenant d’une extrudeuse, un type de tête d’impression mobile. Cela tend à être un processus plus contrôlé et plus doux pour le dépôt de matériaux ou de cellules, et permet d’utiliser de plus grandes densités de cellules dans la construction de structures 3D de tissus ou d’organes. Cependant, ces avantages sont contrariés par les vitesses d’impression plus lentes entraînées par cette technique. La bioimpression par extrusion est souvent associée à la lumière UV, qui photopolymérise le matériau imprimé pour former une construction intégrée plus stable.
Matériel d’impression
Les matériaux pour l’impression 3D sont généralement constitués de polymères d’alginate ou de fibrine, intégrés aux molécules d’adhésion cellulaire, qui favorisent la fixation physique des cellules. De tels polymères sont spécifiquement conçus pour maintenir la stabilité structurelle et être réceptifs à l’intégration cellulaire. Le terme « bioink » a été utilisé comme une vaste classification de matériaux compatibles avec la bioimpression 3D.
Les matériaux d’impression doivent répondre à un large éventail de critères, l’un des principaux étant la biocompatibilité. Les échafaudages résultants formés par des matériaux imprimés en 3D devraient être physiquement et chimiquement appropriés pour la prolifération cellulaire. La biodégradabilité est un autre facteur important, qui garantit que la structure formée artificiellement peut être décomposée après une greffe réussie pour être remplacée par une structure cellulaire complètement naturelle. En raison de la nature de l’impression 3D, les matériaux utilisés doivent être personnalisables et adaptables, adaptés à un large éventail de types de cellules et de conformations structurelles.
Les alginates d’hydrogel sont devenus l’un des matériaux les plus couramment utilisés dans la recherche sur l’impression d’organes, car ils sont hautement personnalisables et peuvent être ajustés pour simuler certaines propriétés mécaniques et biologiques caractéristiques des tissus naturels. La capacité des hydrogels à être adaptés à des besoins spécifiques leur permet d’être utilisés comme matériau d’échafaudage adaptable, adapté à une variété de structures de tissus ou d’organes et à des conditions physiologiques. Un problème majeur dans l’utilisation de l’alginate est sa stabilité et sa lente dégradation, ce qui rend difficile la décomposition de l’échafaudage en gel artificiel et son remplacement par la matrice extracellulaire des cellules implantées. L’hydrogel d’alginate qui convient à l’impression par extrusion est également souvent moins solide du point de vue structurel et mécanique; cependant, ce problème peut être résolu par l’incorporation d’autres biopolymères, tels que la nanocellulose, pour fournir une plus grande stabilité. Les propriétés de l’alginate ou du polymère mixte bioink peuvent être modifiées et peuvent être modifiées pour différentes applications et types d’organes.
Structures d’orgue
Si de nombreux problèmes techniques liés à l’impression d’organes sont communs à d’autres applications de la bioimpression 3D, certains éléments structurels spécifiques à un organe doivent être pris en compte pour la création réussie d’un organe imprimé transplantable.
Vascularisation
Le transfert des nutriments et de l’oxygène aux cellules à travers un organe imprimé est essentiel à sa fonction. Dans les très petits ou minces tissus de moins d’un millimètre d’épaisseur, les cellules peuvent recevoir des nutriments par diffusion. Cependant, les organes plus grands nécessitent le transport des nutriments vers les cellules plus profondes à l’intérieur du tissu, ce qui nécessite que le tissu soit vascularisé, et donc capable de recevoir du sang pour l’échange de cargaison comme l’oxygène et les déchets cellulaires. Les premières techniques d’impression d’organes ont créé des tissus solides qu’il était impossible de vasculariser ou qui ont été vascularisés lentement lorsque les vaisseaux sanguins de l’hôte sont entrés dans la greffe, ce qui a entraîné des problèmes tels que la nécrose des tissus pouvant menacer la santé et le rétablissement réussi du greffé. Des techniques plus récentes permettent de créer des organes imprimés avec une structure 3D plus complexe, y compris un système vasculaire interne préexistant, permettant une intégration plus rapide de la greffe dans le système circulatoire hôte. De nombreuses techniques de création de systèmes vasculaires sont en cours de développement. Une méthode consiste à imprimer séparément par extrusion des récipients qui sont ensuite incorporés à un tissu plus grand. Une autre méthode est l’impression sacrificielle, dans laquelle le tissu entier est imprimé en une fois, et un bio-lien soluble ou autrement amovible est utilisé pour former l’intérieur des vaisseaux. Une fois que cet échafaudage sacrificiel est retiré, généralement par une méthode chimique ou thermique, le reste du tissu contient alors un motif vasculaire.
Sources de cellules
La création d’un organe complet nécessite souvent l’incorporation d’une variété de types de cellules différents, disposés de manière distincte et structurée. Un avantage des organes imprimés en 3D par rapport aux greffes traditionnelles est la possibilité d’utiliser des cellules dérivées du patient pour fabriquer le nouvel organe. Cela réduit considérablement le risque de rejet de greffe et peut supprimer le besoin de médicaments immunosuppresseurs après la greffe, ce qui réduirait les risques pour la santé des greffes. Cependant, comme il n’est pas toujours possible de collecter tous les types de cellules nécessaires, il peut s’avérer nécessaire de collecter des cellules souches adultes ou d’induire une pluripotence dans les tissus collectés. Cela implique une croissance et une différenciation cellulaire gourmandes en ressources et s’accompagne de son propre ensemble de risques potentiels pour la santé, car la prolifération cellulaire dans un organe imprimé se produit à l’extérieur du corps et nécessite l’application externe de facteurs de croissance. Cependant, la capacité de certains tissus à s’auto-organiser en structures différenciées peut fournir un moyen de construire simultanément les tissus et de former des populations cellulaires distinctes, améliorant ainsi l’efficacité et la fonctionnalité de l’impression d’organes.