Печатный орган представляет собой искусственно созданное устройство, предназначенное для замены органа, которое производится с использованием технологий 3D-печати. Основная цель печатных органов заключается в трансплантации. В настоящее время проводятся исследования искусственных структур сердца, почек и печени, а также других основных органов. Для более сложных органов, таких как сердце, небольшие исследования, такие как сердечные клапаны, также были предметом исследований. Некоторые печатные органы приближаются к функциональным требованиям для клинической реализации и в первую очередь включают полые структуры, такие как мочевой пузырь, а также сосудистые структуры, такие как мочевые трубки.
Трехмерная печать позволяет создавать поэтапную конструкцию конкретной структуры органа для формирования клеточного леса. За этим может последовать процесс клеточного посева, в котором клетки, представляющие интерес, пипетируются непосредственно на структуру лесов. Кроме того, был исследован процесс интеграции ячеек в сам материал для печати, вместо того, чтобы проводить посев впоследствии.
Модифицированные струйные принтеры использовались для производства трехмерной биологической ткани. Картриджи для принтеров заполнены суспензией живых клеток и умным гелем, последний используется для обеспечения структуры. Чередующиеся образцы умного гел и живых клеток печатаются с использованием стандартного сопла для печати, при этом клетки в конечном итоге соединяются вместе для образования ткани. По завершении геля охлаждают и смывают, оставляя только живые клетки.
история
Трехмерная печать для создания клеточной конструкции была впервые представлена в 2003 году, когда Томас Боланд из Клемсон Университет запатентовал использование струйной печати для ячеек. В этом процессе использовалась модифицированная система определения пятен для осаждения клеток в организованные 3D-матрицы, размещенные на подложке.
Начиная с первоначальных данных Боланда, трехмерная печать биологических структур, также известная как биопреследование, получила дальнейшее развитие, чтобы охватить производство тканей и структур органов, в отличие от матриц клеток. Кроме того, были исследованы и впоследствии введены в качестве средств производства больше методов печати, таких как биотканирование экструзией.
Органическую печать рассматривали как возможное решение проблемы глобальной нехватки донорских органов. Органы, которые были успешно напечатаны и внедрены в клинических условиях, либо плоские, такие как кожа, сосудистые, такие как кровеносные сосуды или полые, такие как мочевой пузырь. Когда искусственные органы готовятся к трансплантации, их часто производят с собственными клетками реципиента.
Более сложные органы, а именно те, которые состоят из твердых клеточных структур, проходят исследования; эти органы включают сердце, поджелудочную железу и почки. Оценки того, когда такие органы могут быть введены в качестве жизнеспособного медицинского лечения, различны. В 2013 году компания «Органово» выпустила печень человека с использованием трехмерной биопринтинга, хотя она не подходит для трансплантации и в основном используется в качестве среды для тестирования на наркотики.
подходы
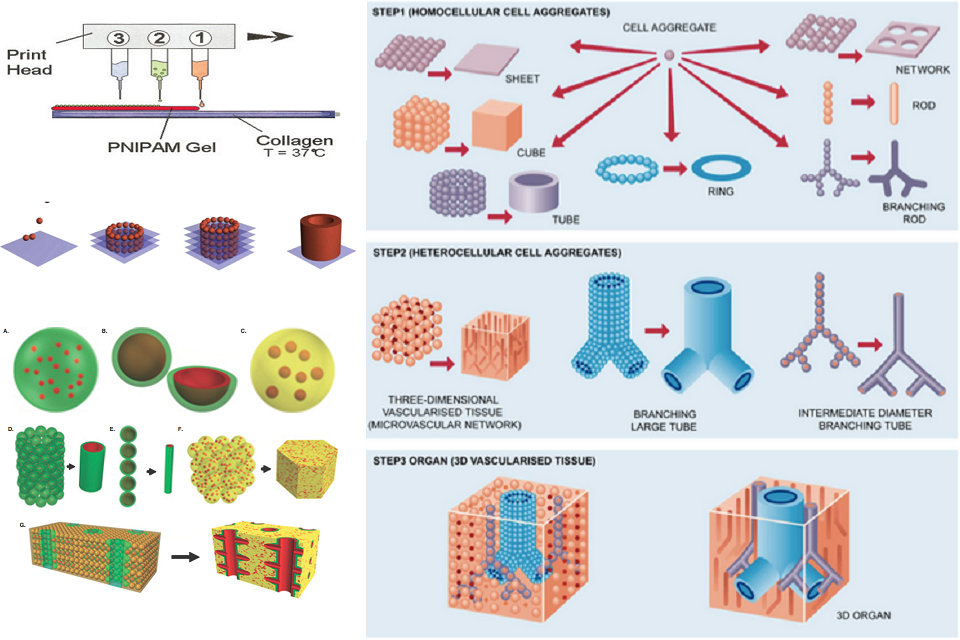
Исследователи разработали различные подходы к производству живых синтетических органов. Трехмерная биопечати основана на трех основных подходах: биомимике, автономной самосборке и построении мини-тканевых блоков.
Biomimicry
Первый подход к биопечати называется биомимикой. Основная цель этого подхода — создать структуры, идентичные естественным структурам. Биомимика требует дублирования формы, структуры и микро-среды органов и тканей. Применение биомимикрии в биопечати включает идентичную копию клеточной и внеклеточной частей органов. Чтобы этот подход был успешным, требуется репликация ткани в микроскопическом масштабе. Эта степень точности включает в себя понимание микросреды, характер биологических сил, точную организацию клеток, факторы растворимости и состав и структуру внеклеточного матрикса.
Самоорганизация
Второй подход, используемый в биопечати, — автономная самосборка. Этот подход основан на естественном физическом процессе развития эмбриональных органов. Когда клетки находятся на ранней стадии разработки, они создают свой собственный внеклеточный матричный строительный блок и создают собственную собственную сигнализацию сотовой связи и берут макет и микроархитектуру, необходимые для обеспечения ожидаемых биологических функций. Автономная самосборка требует знания процессов развития тканей и органов у эмбрионов. Автономная самосборка опирается на возможности ячеек как фундаментального строительного блока гистогенеза. Поэтому этот метод требует очень глубокого понимания механизмов развития эмбриональной ткани, а также микросреды, в которых растут ткани.
Мини-ткань
Третий подход к биопечати представляет собой комбинацию как биомиметических, так и самосборных подходов. Этот метод называют «мини-тканями». Органы и ткани изготовлены из очень маленьких функциональных компонентов. Подход мини-ткани состоит в том, чтобы взять эти маленькие кусочки и устроить их в более крупной структуре. Этот подход использует две разные стратегии. Первой стратегией является использование самосборных клеточных сфер в крупномасштабных тканях с использованием естественных узоров в качестве руководства. Вторая стратегия — разработать точные репродукции и высокое качество ткани и позволить им автоматически монтироваться в больших функциональных тканях в масштабе. Смешение этих стратегий необходимо для печати сложной трехмерной биологической структуры.
Органическая печать имеет большой потенциал для технологий NBIC (нано, био, информация и познавательные) для продвижения медикаментов и хирургических процедур, чтобы сэкономить время, снизить затраты и создать новые возможности для пациентов и пациентов. медицинских работников.
Технологии 3D-печати
Трехмерная печать для изготовления искусственных органов стала основной темой исследования в области биологической инженерии. Поскольку быстрые технологии производства, связанные с 3D-печатью, становятся все более эффективными, их применение в синтезе искусственных органов стало более очевидным. Некоторые из основных преимуществ 3D-печати заключаются в его способности создавать массовые структуры лесов, а также высокую степень анатомической точности в строительных материалах. Это позволяет создавать конструкции, которые более эффективно напоминают микроструктуру естественного органа или структуры ткани.
Органическая печать с использованием 3D-печати может быть проведена с использованием различных методов, каждая из которых дает конкретные преимущества, которые могут быть пригодны для конкретных типов производства органов. Двумя наиболее известными типами органной печати являются биотрансформация и биопреследование. Многочисленные другие существуют, хотя и не так часто используются или все еще находятся в разработке.
Падение на основе биопринтинга (Inkjet)
Биопринтинг на основе капель создает клеточные конструкции с использованием отдельных капель определенного материала, который часто объединяется с клеточной линией. При контакте с поверхностью подложки каждая капля начинает полимеризоваться, образуя большую структуру, когда отдельные капли начинают сливаться. Полимеризация инициируется присутствием ионов кальция на субстрате, которые диффундируют в сжиженный биоиндикатор и позволяют образовывать твердый гель. Из-за его эффективной скорости обычно используется биотканивание на основе падений, хотя этот аспект делает его менее подходящим для более сложных структур органов.
Экструзионная биопринтинг
Экструзионная биопреобразование включает в себя постоянное осаждение конкретного печатного материала и клеточной линии из экструдера, типа мобильной печатающей головки. Это, как правило, более контролируемый и более мягкий процесс осаждения материала или клеток и позволяет использовать большую плотность клеток при построении трехмерных тканей или структур органов. Однако такие преимущества задерживаются медленными скоростями печати, вызванными этой техникой. Экструзионная биотрансляция часто сочетается с УФ-светом, который фотополимеризует печатный материал для формирования более стабильной интегрированной конструкции.
Печатные материалы
Материалы для трехмерной печати обычно состоят из альгинатных или фибриновых полимеров, которые были объединены с молекулами клеточной адгезии, которые поддерживают физическое прикрепление клеток. Такие полимеры специально разработаны для поддержания структурной стабильности и могут быть восприимчивы к клеточной интеграции. Термин «биоиндикатор» использовался как широкая классификация материалов, совместимых с 3D-биотрансляцией.
Печатные материалы должны соответствовать широкому спектру критериев, одним из которых является биосовместимость. Полученные строительные леса, образованные 3D-печатными материалами, должны быть физически и химически пригодными для клеточной пролиферации. Еще одним важным фактором является биологическая разлагаемость и гарантирует, что искусственно сформированная структура может быть разрушена при успешной трансплантации, которая должна быть заменена полностью естественной клеточной структурой. Из-за характера 3D-печати используемые материалы должны быть настраиваемыми и адаптируемыми, подходящими для широкого спектра типов ячеек и структурных конформаций.
Гидрогелевые альгинаты стали одним из наиболее часто используемых материалов в исследованиях органов печати, так как они очень настраиваемые и могут быть точно настроены для моделирования определенных механических и биологических свойств, характерных для натуральных тканей. Способность гидрогелей адаптироваться к конкретным потребностям позволяет использовать их в качестве адаптируемого каркасного материала, который подходит для различных тканевых или органных структур и физиологических условий. Основной проблемой при использовании альгината является его стабильность и медленная деградация, что затрудняет разрушение искусственных гелевых лесов и заменяет собой внеклеточный матрикс имплантированных клеток. Гидрогель с альгинатом, который подходит для экструзионной печати, также часто менее структурно и механически звучит; однако этот вопрос может быть обусловлен включением других биополимеров, таких как наноцеллюлоза, для обеспечения большей стабильности. Свойства альгината или смешанного полимера биоиндуцируются и могут быть изменены для различных применений и типов органов.
Органические структуры
В то время как многие технические проблемы печатания органов разделяются с другими приложениями 3D-биопринтинга, существуют некоторые структурные элементы, специфичные для органа, которые необходимо решать для успешного создания трансплантируемого печатного органа.
васкуляризация
Передача питательных веществ и кислорода в клетки по всему печатному органу имеет важное значение для его функционирования. В очень маленьких или тонких тканях толщиной менее миллиметра клетки могут получать питательные вещества через диффузию. Однако более крупные органы требуют переноса питательных веществ в клетки глубже внутри ткани, что требует, чтобы ткань была васкуляризирована и, таким образом, могла получать кровь для обмена груза, такого как кислород и отходы клеток. Методы ранней органной печати создавали твердые ткани, которые не могли васкуляризировать или васкуляризировали только медленно, когда принимающие кровеносные сосуды вошли в трансплантат, что привело к таким проблемам, как некроз внутри ткани, который может угрожать здоровью и успешному восстановлению реципиента трансплантата. Совсем недавно разработанные методы позволяют создавать печатные органы с более сложной трехмерной структурой, включая существующую внутреннюю сосудистую систему, которая позволяет быстрее интегрировать трансплантат в систему кровообращения хозяина. Существует несколько методов создания сосудистых систем, находящихся в стадии разработки. Одним из методов является отдельная экструзионная печать сосудов, которые затем включаются в большую ткань. Другим методом является печатная печать, в которой вся ткань печатается сразу, и для образования внутренней поверхности сосудов используется растворимая или иным образом удаляемая биоиндикация. Как только эти жертвенные леса удаляются, обычно химическим или термическим методом, остальная часть ткани затем содержит сосудистый рисунок.
Источники клеток
Для создания полного органа часто требуется включение различных типов клеток, расположенных по-разному и узорчатым. Одним из преимуществ трехмерных печатных органов, по сравнению с традиционными трансплантатами, является возможность использовать клетки, полученные от пациента, чтобы создать новый орган. Это значительно снижает вероятность отторжения трансплантата и может устранить потребность в иммунодепрессантах после трансплантации, что снизит риск для здоровья трансплантатов. Однако, поскольку не всегда возможно собрать все необходимые типы клеток, может потребоваться сбор взрослых стволовых клеток или индуцирование плюрипотентности в собранной ткани. Это включает в себя ресурсоемкий рост клеток и их дифференциацию и поставляется с собственным набором потенциальных рисков для здоровья, поскольку пролиферация клеток в печатном органе происходит вне тела и требует внешнего применения факторов роста. Однако способность отдельных тканей к самоорганизации в дифференцированные структуры может обеспечить способ одновременного создания тканей и формирования различных популяций клеток, повышения эффективности и функциональности органной печати.